MyChoice®CDx PLUS


Test HRD su tessuto tumorale
Determinazione del deficit di ricombinazione omologa (HRD) nel tumore ovarico
MyChoice CDx Plus è un test genomico che guida le decisioni mediche nel trattamento del tumore ovarico con farmaci PARP-inibitori.
Il test è eseguito nei laboratori Myriad Genetics USA su un campione di tessuto tumorale ovarico.
Viene effettuata la ricerca delle mutazioni BRCA1 e BRCA2 e viene determinato il punteggio di instabilità genomica GIS (Genomic Instability Score), per ottenere uno score HRD integrato e accurato. (1-4).
HRD = BRCA1/2+GIS
MyChoice CDx Plus identifica tempestivamente le pazienti eleggibili al trattamento con farmaci inibitori PARP ed è il test HRD più validato nel tumore ovarico. (1,5-8)
MyChoice CDx Plus è l’unico test HRD con
-
- approvazione FDA,(9)
- certificazione CE,
- raccomandazione nelle principali linee guida internazionali sul trattamento(10-12) e
- dati prospettici da studi di fase III.(1,5-8)
MyChoice CDx Plus è un dispositivo con marchio CE, progettato per conformarsi agli standard applicabili e ai requisiti generali di sicurezza e prestazione della Direttiva Europea 98/79/CE (dispositivi medico-diagnostici in vitro). La dichiarazione di conformità viene rilasciata sotto la responsabilità di Myriad Genetic Laboratories, Inc.
Bibliografia
1. Ray-Coquard, Isabelle, et al. “Olaparib Plus Bevacizumab as First-Line Maintenance in Ovarian Cancer.” New England Journal of Medicine, vol. 381, no. 25, 2019, pp. 2416–2428.
2. Timms, Kirsten M, et al. “Comparison of Genomic Instability Test Scores Used for Predicting PARP Activity in Ovarian Cancer.” Journal of Clinical Oncology, vol. 38, no. 15_suppl, 2020, pp. 1586–1586.
3. Watkins, Johnathan A et al. “Genomic Scars As Biomarkers Of Homologous Recombination Deficiency And Drug Response In Breast And Ovarian Cancers”. Breast Cancer Research, vol 16, no. 3, 2014.
4. The Cancer Genome Atlas Research Network. Nature 2011.
5. Ray-Coquard, Isabelle, et al. “Olaparib Plus Bevacizuamb First-Line Maintenance in Ovarian Cancer: Final Overall Survival Results from the Paola-1/ENGOT-OV25 Trial.” Annals of Oncology, vol. 34, no. 8, 2023, pp. 681–692.
6. González-Martín, Antonio, et al. “Niraparib in Patients with Newly Diagnosed Advanced Ovarian Cancer.” New England Journal of Medicine, vol. 381, no. 25, 2019, pp. 2391–2402.
7. González-Martín, Antonio, et al. “Progression-Free Survival and Safety at 3.5 Years of Follow-up: Results from the Randomised Phase 3 Prima/Engot-OV26/GOG-3012 Trial of Niraparib Maintenance Treatment in Patients with Newly Diagnosed Ovarian Cancer.” European Journal of Cancer, vol. 189, 2023, p. 112908.
8. Coleman, Robert L., et al. “Veliparib with First-Line Chemotherapy and as Maintenance Therapy in Ovarian Cancer.” New England Journal of Medicine, vol. 381, no. 25, 2019, pp. 2403–2415.
9. Cristescu, Razvan et al. “428 Genomic Instability Metric Concordance Between Oncoscan™, Cytosnp And An Fda-Approved HRD Test”. Translational Research, 2020.
10. Tew, William P., et al. “Poly(ADP-Ribose) Polymerase Inhibitors in the Management of Ovarian Cancer: ASCO Guideline Rapid Recommendation Update.” Journal of Clinical Oncology, vol. 40, no. 33, 2022, pp. 3878–3881.
11. Miller, Rowan E. et al. “ESMO Recommendations On Predictive Biomarker Testing For Homologous Recombination Deficiency And PARP Inhibitor Benefit In Ovarian Cancer”. Annals Of Oncology, vol 31, no. 12, 2020, pp. 1606-1622.
12. National Comprehensive Cancer Network. Ovarian Cancer/Fallopian Tube Cancer/Primary Peritoneal Cancer. Version 1.2023.
Conoscere lo stato HRD è fondamentale per determinare le opzioni di trattamento del cancro ovarico
Una condizione di deficit di ricombinazione omologa (HRD) è presente nel 48% circa dei tumori ovarici(1) ed è spesso dovuta ad una mutazione che si riscontra solo nel tumore.

Tuttavia, mentre alcune cause di HRD sono ben accertate, altre rimangono sconosciute.(2,3,4)
Determinare lo stato HRD per le pazienti con cancro ovarico può aiutare a fornire informazioni sull’entità del beneficio della terapia con inibitori PARP, che determina risultati ottimali per le pazienti con HRD+ .
Le specifiche tecniche del test MyChoice CDx Plus si trovano qui.
La valutazione di LOH, TAI e LST consente la determinazione di HRD indipendentemente dalla causa specifica.(3), mentre sarebbe molto difficile esaminare ogni singola causa. Ecco perchè_
● HRD derivante da eventi epigenetici come la metilazione del promotore BRCA1 non verrebbe rilevato con un approccio di sequenziamento genico.(5,6)
● Mutazioni genetiche in ambito HR diverse da BRCA1 e BRCA2 sono rare e non è chiaro se siano collegate a HRD.(7,8)
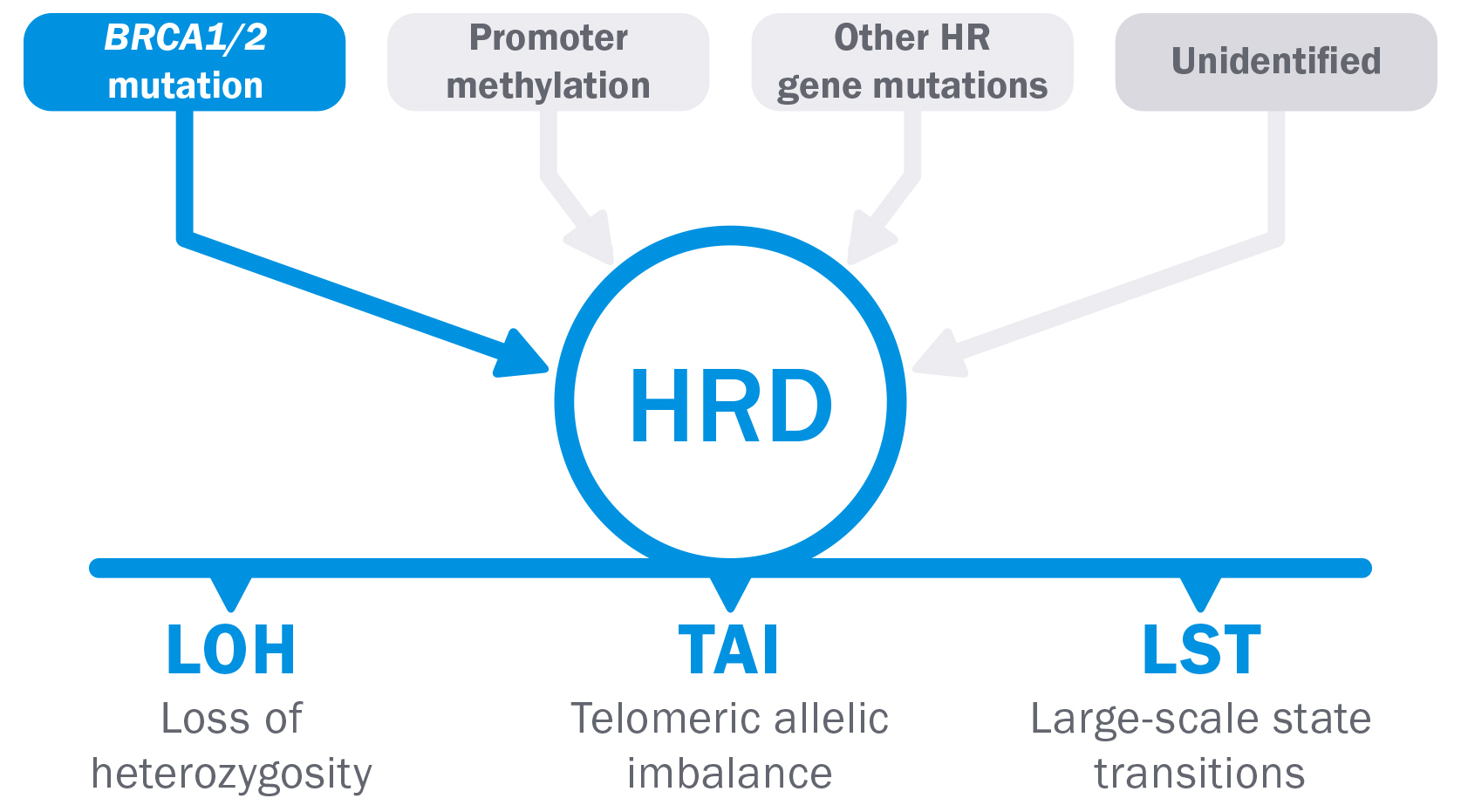
Le cause non identificate di HRD non vengono rilevate.
 |
BRCA1/2
|
 |
LOH + TAI + LST
|
MyChoiceCDx PLUS determina lo stato HRD in varie modalità, per risultati più completi.
MyChoice esamina i tumori del cancro ovarico utilizzando due metodi (mutazione BRCA1/2 e instabilità genomica) per determinare lo stato HRD di una paziente.
MyChoice, il test HRD di riferimento
Accurato
MyChoice identifica il 34% in più di tumori con HRD rispetto ai test che utilizzano solo %LOH .5
Rapido
I medici riceveranno un risultato MyChoice entro 2-3 settimane dalla ricezione del campione da parte del laboratorio
Azionabile
Risultati MyChoice di facile lettura con l’interpretazione del GIS, di BRCA1/BRCA2 e risultati combinati per prendere decisioni informate sul trattamento
Affidabile
FDA, PMDA, ASCO, NCCN e ESMO si fidano di MyChoice. (9-12)
Il test HRD più completo e accurato per prendere decisioni terapeutiche in pochi giorni
È stato dimostrato che MyChoice è in grado di identificare il 34% in più di tumori con HRD rispetto ad altri metodi che utilizzano solo %LOH (5): offre informazioni più accurate per prendere decisioni informate sul trattamento.
● 27.000 SNPs permettono un’analisi più definita del genoma rispetto al solo %LOH, che impiega 3.500 SNP ed esamina solo una porzione del genoma.
● Tecnologia che analizza BRCA1/2 tramite varianti di sequenza e ampi riarrangiamenti, catturando così il 5% in più rispetto di altre piattaforme che non dispongono di questa tecnologia.5,13,14
Validazione clinica completa
MyChoice è l’unico test HRD validato prospetticamente in tre studi di fase III per l’impiego nel trattamento di prima linea del cancro ovarico.14-18
Dati robusti a lungo termine confermano che il test MyChoice migliora la sopravvivenza nelle pazienti con cancro ovarico avanzato di nuova diagnosi che ricevono trattamenti di prima linea.14-18
PAOLA-1 n= 806
PRIMA n= 733
VELIA n=1.140
I test HRD non sono intercambiabili
| Altri test HRD |
MyChoiceCDx
|
||
| BRCA1 & BRCA2 | Varianti di Sequenza | Si | Si |
|
Ampi Riarrangiamenti
|
No | Si | |
| Genomic Instability Score | Perdita di eterozigosi (LOH) | Si | Si |
|
Squilibrio telomerico allelico (TAI)
|
No | Si | |
| Transizioni di stato su ampia scala (LST) | No | Si |
Ritenuto affidabile nel mondo
MyChoice CDx è menzionato nelle linee guida ed è l’unico test HRD con livello di evidenza 1A (LoE1A) validato in numerosi studi di fase III per il trattamento di prima linea del cancro ovarico con inibitori PARP.14-18
Raccomandato da NCCN(12)
I test somatici dovrebbero dare priorità all’identificazione delle alterazioni molecolari che permettono l’adozione di interventi efficaci. Ciò include la valutazione dello stato di BRCA1/2, perdita di eterozigosi (LOH) o deficit di ricombinazione omologa (HRD) in assenza di una mutazione BRCA germinale.
Raccomandato da ASCO(9)
Myriad MyChoice CDx è incluso nelle raccomandazioni dell’American Society of Clinical Oncology (ASCO) sull’uso degli inibitori PARP per il trattamento e la gestione di alcune pazienti con cancro ovarico avanzato.
Raccomandato da ESMO(10)
Test HRD validati basati su cicatrici genomiche possono essere utilizzati per guidare il trattamento con gli inibitori PARP.
ESMO riconosce che MyChoice CDx è l’unico test HRD basato su cicatrici validato nel contesto di mantenimento di prima linea.
Referti chiari e comprensibili
Elementi chiave del referto:
● Punteggio di instabilità genomica (GIS).
● Mutazione BRCA1/BRCA2 tumorale (tBRCA1/2)
● Interpretazione di eventuali varianti somatiche BRCA1 e BRCA2
● Interpretazione complessiva del test più rilevante per la gestione del paziente (se vengono rilevate più varianti)
Specifiche Tecniche (in Inglese)
Bibliografia
1. Moore, Kathleen N, et al. “Niraparib Monotherapy for Late-Line Treatment of Ovarian Cancer (Quadra): A Multicentre, Open-Label, Single-Arm, Phase 2 Trial.” The Lancet Oncology, vol. 20, no. 5, 2019, pp. 636–648.
2. Da Cunha Colombo Bonadio, Renata Rodrigues, et al. “Homologous Recombination Deficiency in Ovarian Cancer: A Review of Its Epidemiology and Management.” Clinics, 73(Suppl 1), 2018, p. e450s.
3. Watkins, Johnathan A et al. “Genomic Scars As Biomarkers Of Homologous Recombination Deficiency And Drug Response In Breast And Ovarian Cancers”. Breast Cancer Research, vol 16, no. 3, 2014.
4. Konstantinopoulos, Panagiotis A., et al. “Homologous Recombination Deficiency: Exploiting the Fundamental Vulnerability of Ovarian Cancer.” Cancer Discovery, vol. 5, no. 11, 2015, pp. 1137–1154.
5. Timms, Kirsten M, et al. “Comparison of Genomic Instability Test Scores Used for Predicting PARP Activity in Ovarian Cancer.” Journal of Clinical Oncology, vol. 38, no. 15_suppl, 2020, pp. 1586–1586.
6. Baldwin, Rae L. et al. “BRCA1 Promoter Region Hypermethylation in Ovarian Carcinoma: A Population-based Study.” Cancer Research, vol. 60, no. 19, 2000, pp. 5329-5333.
Norquist, Barbara M. et al. “Inherited Mutations In Women With Ovarian Carcinoma”. JAMA Oncology, vol 2, no. 4, 2016, p. 482.
7. The Cancer Genome Atlas Research Network. “Integrated Genomic Analyses Of Ovarian Carcinoma”. Nature, vol 474, no. 7353, 2011, pp. 609-615.
8. Weichert, W et al. “216 An Evaluation Of The Performance Of Molecular Assays To Identify Homologous Recombination Deficiency-Positive Tumours In Ovarian Cancer”. Late Breaking Abstracts, 2021.
9. Tew, William P., et al. “Poly(ADP-Ribose) Polymerase Inhibitors in the Management of Ovarian Cancer: ASCO Guideline Rapid Recommendation Update.” Journal of Clinical Oncology, vol. 40, no. 33, 2022, pp. 3878–3881.
10. Miller, Rowan E. et al. “ESMO Recommendations On Predictive Biomarker Testing For Homologous Recombination Deficiency And PARP Inhibitor Benefit In Ovarian Cancer”. Annals Of Oncology, vol 31, no. 12, 2020, pp. 1606-1622.
11. Cristescu, Razvan et al. “428 Genomic Instability Metric Concordance Between Oncoscan™, Cytosnp And An Fda-Approved HRD Test”. Translational Research, 2020.
12. National Comprehensive Cancer Network. Ovarian Cancer/Fallopian Tube Cancer/Primary Peritoneal Cancer. Version 1.2023.
13. https://info.foundationmedicine.com/hubfs/FMI%20Labels/FoundationOne_CDx_Label_Technical_Info.pdf
14. Ray-Coquard, Isabelle, et al. “Olaparib plus Bevacizumab First-Line Maintenance in Ovarian Cancer: Final Overall Survival Results from the Paola-1/ENGOT-OV25 Trial.” Annals of Oncology, vol. 34, no. 8, 2023, pp. 681–692.
15. Ray-Coquard, Isabelle, et al. “Olaparib plus Bevacizumab as First-Line Maintenance in Ovarian Cancer.” New England Journal of Medicine, vol. 381, no. 25, 2019, pp. 2416–2428.
16. González-Martín, Antonio, et al. “Niraparib in Patients with Newly Diagnosed Advanced Ovarian Cancer.” New England Journal of Medicine, vol. 381, no. 25, 2019, pp. 2391–2402.
17. González-Martín, Antonio, et al. “Progression-Free Survival and Safety at 3.5 Years of Follow-up: Results from the Randomised Phase 3 Prima/Engot-OV26/GOG-3012 Trial of Niraparib Maintenance Treatment in Patients with Newly Diagnosed Ovarian Cancer.” European Journal of Cancer, vol. 189, 2023, p. 112908.
18. Coleman, Robert L., et al. “Veliparib with First-Line Chemotherapy and as Maintenance Therapy in Ovarian Cancer.” New England Journal of Medicine, vol. 381, no. 25, 2019, pp. 2403–2415.
19. Denkert, Carsten, et al. “Homologous Recombination Deficiency as an Ovarian Cancer Biomarker in a Real-World Cohort.” The Journal of Molecular Diagnostics, vol. 24, no. 12, 2022, pp. 1254-1263.
Per informazioni
Telefono
+39 0240090222
oncology@did.it
Il contenuto di questo sito web è informativo sull'azienda Quimark e i suoi prodotti e servizi,
non è inteso come consulenza medica o sanitaria professionale


